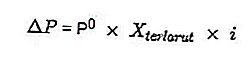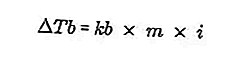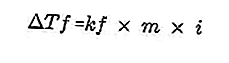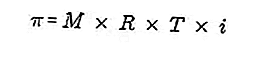Попробуйте обратить внимание на то, что вокруг нас связано с химией? Самый легкий - это воздух, которым мы дышим, который содержит смесь кислорода, азота и других газов. Пищевые приправы, пищевые красители и пищевые консерванты также являются примерами химических веществ, которые нас окружают. Химия - это отрасль естествознания, которую вы будете изучать в школе, которая изучает различные материалы, одним из примеров является структура материи, свойства материи, материальная форма, изменения в материи, классификация материи, состав вещества и энергии, которые сопровождают эти изменения. Вы знаете, что не только математика и физика, химия также имеет различные виды формул. Есть много химических формул, из которых вы узнаете, от коллигативных свойств до окислительно-восстановительных реакций.
По этому случаю мы узнаем различные химические формулы, а также примеры их проблем, которые помогут вам понять концепции химических формул.
Химические формулы и примеры задач
Наличие формул в химии помогает исследователям находить различные виды экспериментальных результатов, которые нужно проводить. Чтобы хорошо овладеть этой наукой, вы должны знать некоторые химические формулы, с которыми вы часто будете сталкиваться при изучении химии.
Формула коллигативных свойств решений.
Коллигативный характер раствора - это характеристика раствора, которая не зависит от типа растворимого вещества, а зависит только от концентрации частиц раствора. Тогда коллигативная природа раствора состоит из двух типов свойств, а именно коллигативной природы раствора электролита и коллигативной природы раствора неэлектролита.
- Коллигативные свойства растворов неэлектролитов
Хотя коллигативный характер включает раствор, коллигативный характер зависит не от взаимодействия растворенного вещества и молекул растворенного вещества, а от количества растворенного вещества, растворенного в растворе. Коллигативные свойства заключаются в снижении давления пара, повышении температуры кипения, понижении температуры замерзания и осмотического давления. Каждому из них требуется химическая формула, чтобы получить результат.
- Уравнение падения давления пара

Источник: formula.co.id
- Уравнение повышения температуры кипения
Точка кипения жидкости - это фиксированная температура, при которой она кипит. При этой температуре давление пара жидкости имеет уравнение для давления воздуха вокруг него и вызвано испарением всех частей жидкости. Точку кипения жидкости можно измерить давлением в 1 атмосферу.
Разница в температуре кипения раствора и точки кипения чистого растворителя называется повышением температуры кипения, уравнение увеличения температуры кипения имеет следующий вид:

Источник: formula.co.id
- Уравнение для вывода точки замерзания
Присутствие растворенного вещества в растворе делает точку замерзания раствора меньше, чем точка замерзания растворителя. Уравнение снижения точки замерзания:

Источник: formula.co.id
- Осмотическое давление
Осмотическое давление - это сила, необходимая для уравновешивания давления растворителя через полупроницаемую мембрану через раствор.
Полупроницаемая мембрана - это мембрана, через которую могут проходить молекулы растворителя, но не могут проходить растворенные вещества. Согласно Вант-Хоффу, при осмотическом давлении раствор имеет следующую формулу:

Источник: formula.co.id
- Коллигативные свойства растворов электролитов
В отношении концентрации коллигативные свойства одного и того же раствора электролита имеют большее значение, если мы сравниваем его с коллигативными свойствами раствора неэлектролита. Поскольку большое количество частиц растворенного вещества является результатом реакции ионизации раствора электролита, который был разработан с учетом фактора Вант-Гоффа.
Расчет коллигативных свойств растворов электролитов всегда будет умножаться на коэффициент Вант-Гоффа следующим образом:

Источник: formula.co.id
Некоторые из формул коллигативных свойств других растворов электролитов:
- Падение давления пара
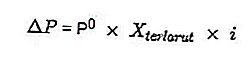
Источник: formula.co.id
- Повышение температуры кипения
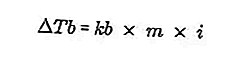
Источник: formula.co.id
- Падение точки замерзания
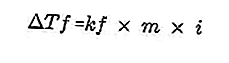
Источник: formula.co.id
- Осмотическое давление
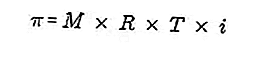
Источник: formula.co.id
Формулы молярности, моляльности и мольной доли
Молярность (M)
Молярность - это количество молей вещества, растворенного в 1 литре раствора.

Источник: formula.co.id
M = молярность
Mr = молярная масса растворенного вещества (г / моль)
V = объем раствора
Моляльность (м)
Моляльность - это количество молей вещества, растворенного в 1 кг растворителя. Химическая формула выглядит следующим образом.

Источник: formula.co.id
m = моляльность (моль / кг)
Mr = молярная масса растворенного вещества (г / моль)
масса = масса растворенного вещества (г)
P = масса растворителя (г)
Мольная фракция
Мольная доля - это единица концентрации, в которой все компоненты раствора рассчитываются в молях.

Источник: formula.co.id
xi = количество молей
i, j, xj = мольная доля
Примеры проблем с химической формулой
1. Если при осмотическом давлении в 500 мл раствора фруктозы C6H12O6 от 32 ° C составляет 2 атм, масса растворенной фруктозы составляет?
Решение:

2. В мольной доле раствора мочевины в воде 0,2. Давление насыщенного пара чистой воды с температурой 20 ° C составляет 17,5 мм рт. Тогда у раствора давление насыщенного пара при следующей температуре составляет?
X мочевина + X вода = 1
0,2 + X воды = 1
X вода = 0,8
Раствор P = X воды x P воды
Р раствора = 0,8 х 17,5 мм рт.
Р раствора = 14 мм рт. Ст.
Это некоторые химические формулы, которым вы можете научиться, чтобы вам было легче отвечать на различные вопросы по химии. Если вы чувствуете, что этих формул недостаточно, вы можете попробовать продукт ПРОБЛЕМА, взвешенное, полное, интерактивное практическое решение для интеллектуального класса, такое как тригонометрия, предел, логарифм и многие другие. Начиная с начальной, средней и средней школы с различными предметами, такими как математика, физика, химия и другие. Здесь вы можете изучить различные виды формул с примерами задач.
Давай, чего ты ждешь! Попробуем ПРОБЛЕМНЫЕ упражнения в Smart Class прямо сейчас.