В предыдущей статье мы обсуждали, что такое окислительно-восстановительная реакция. Окислительно-восстановительные реакции, обычно используемые в областях фармацевтики, биологии, промышленности, металлургии и сельского хозяйства, представляют собой типы окислительных и восстановительных реакций, которые происходят одновременно. Во время окислительно-восстановительной реакции количество потерянных электронов равно количеству полученных электронов.
Редокс-реакции состоят из реакций восстановления и окисления. Восстановление - это процесс удаления кислорода или электроотрицательного элемента из вещества или добавления водорода или электроположительного элемента к веществу. Между тем окисление - это добавление кислорода или любого электроотрицательного элемента к веществу или удаление водорода или любого электроположительного элемента из вещества.
Есть несколько типов окислительно-восстановительных реакций, с которыми мы знакомы, включая реакции сочетания, разложения, обмена и диспропорционирования.
Комбинированная реакция
Комбинированные реакции - это реакции, когда два или более элемента объединяются в одно соединение.
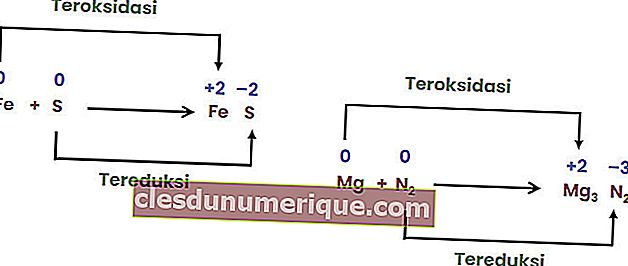
Реакция разложения
Реакция разложения или разложения - это реакция, когда соединение распадается или распадается на два или более простых вещества или элементов. Реакции разложения обычно называют противоположностью комбинированных реакций.
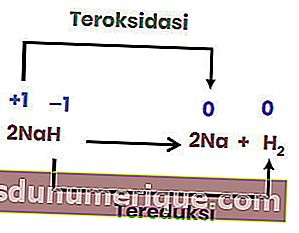
Однако не все реакции разложения являются окислительно-восстановительными. Примером может служить следующая реакция.
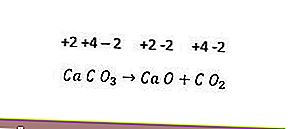
Поскольку степень окисления каждого элемента не меняется, указанная выше реакция не является окислительно-восстановительной реакцией. Чтобы реакция разложения превратилась в окислительно-восстановительную реакцию, по крайней мере, один из образующихся компонентов должен быть в элементарной форме.
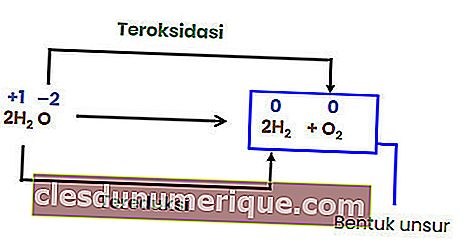
Обменная реакция
Реакция обмена или замещения - это реакция, в которой атомы или ионы в соединении заменяются атомами или ионами другого соединения. Реакции замещения подразделяются на металлические и неметаллические замещения.
(Также читайте: Узнайте о окислительно-восстановительных реакциях)
Замена металла происходит, когда металл в соединении заменяется металлом, который более реакционноспособен в свободном состоянии. Примером является реакция ниже.

Реакции замещения металлов полезны в металлургических процессах, когда чистый металл получают из соединений, присутствующих в руде.
Между тем, реакции замещения неметаллов включают замену водорода, галогенов и иногда кислорода. Все щелочные металлы и некоторые щелочноземельные металлы (Ca, Sr и Ba) заменяют водород из холодной воды. Пример можно увидеть в следующей реакции.
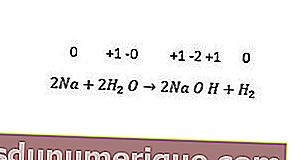
Реакция диспропорционирования
Последний тип окислительно-восстановительной реакции - диспропорционирование. Эта реакция происходит, когда один и тот же элемент одновременно окисляется и восстанавливается. Элементы с тремя или более степенями окисления могут действовать как свои собственные окислители и восстановители. Примером может служить следующая реакция.
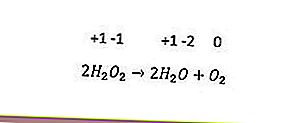
В приведенной выше реакции степень окисления кислорода (-1) снижается до -2 и окисляется до 0.





