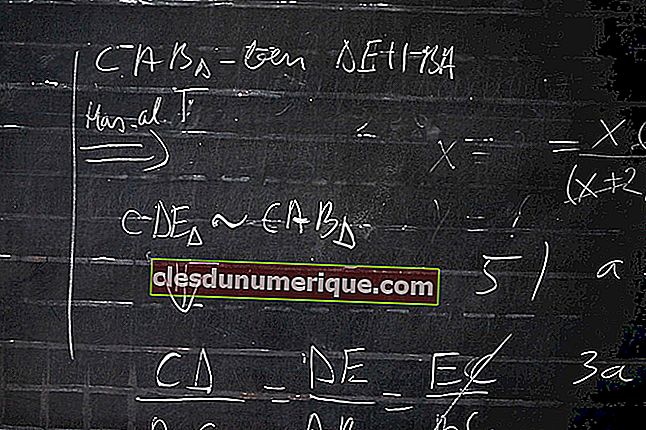В предыдущем обсуждении мы вкратце познакомились с Алканами Алкенами Алкесами, как группой алифатических углеводородов, состоящей из атомов углерода (C) и атомов водорода (H), которые связаны и образуют открытые цепи. Он может быть разветвленным, а может и нет.
Алкановые алканы также имеют соответствующие отличия. Но на этот раз мы глубже разберемся в алканах, от их значения, номенклатуры до физических и химических свойств. На что это будет похоже?
Алканы, как описано ранее, представляют собой насыщенные углеводороды с открытой цепью, содержащие одинарные углерод-углеродные связи. Общая формула алканов:
C n H 2n + 2
В алканах, C - C и C - H, σ-связь образована комбинацией гибридной sp3-орбитали углерода и 1s-орбитали атома водорода.
Номенклатура
Ссылаясь на соглашение IUPAC, номенклатура алкановых соединений записывается с использованием формулы: Префикс + Суффикс. Где префикс представляет количество атомов углерода в алкане. Затем добавьте суффикс «ана»
(Также прочтите: Алканы Алкенес Алкес, Углеводороды, которые мы должны знать)
Например, CH 4 . Число атомов углерода равно одному, поэтому префикс встречается, и с добавлением суффикса название CH 4 по ИЮПАК - Метан.
Изомеры
Алканы с более чем тремя атомами углерода могут быть расположены несколькими способами, образуя различные структурные изомеры.
Алканы могут иметь цепные изомеры. Например, двумя возможными изомерами C 4 H 10 являются:

Физические свойства алканов
Алканы - неполярные молекулы. От C1 до C4 - газы, от C5 до C17 - жидкости, а те, которые содержат 18 или более атомов углерода, являются твердыми веществами при 298 К. Алканы не имеют цвета и запаха. Его температура кипения увеличивается с увеличением молекулярной массы.
Химические свойства алканов
Алканы обычно инертны по отношению к кислотам, основаниям, окислителям и восстановителям. Алканы подвергаются только реакциям замещения.
Характерная реакция алканов - реакция замещения. Примерами реакций замещения являются галогенирование, нитрование и сульфирование. Реакция протекает по свободнорадикальному механизму.
Галогенирование

Нитрация

Горение

Контролируемое окисление

Изомеризация
н-Алканы при нагревании в присутствии безводного хлорида алюминия и газообразного хлористого водорода приводят к изомеризации алканов с разветвленной цепью.

Ароматизация

Пиролиз или крекинг: высшие алканы при более высокой температуре нагрева распадаются на низшие алканы, алкены и другие.