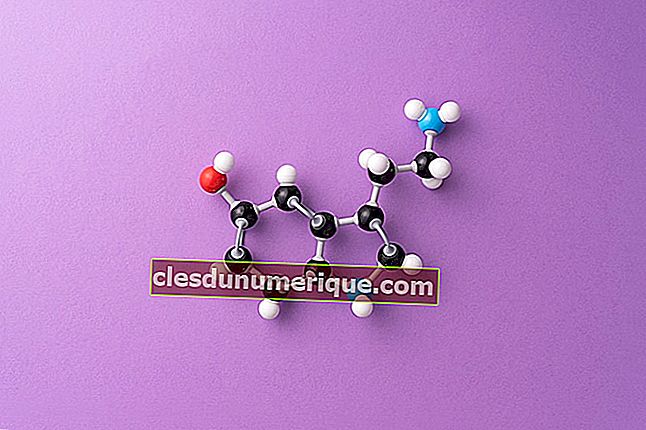
Ссылаясь на Википедию, теория VSEPR или теории отталкивания электронных пар валентной оболочки - это химическая модель, используемая для объяснения форм химических молекул на основе сил электростатического отталкивания между электронными парами. Сама аббревиатура «VSEPR» произносится как «vesper» из-за простоты произношения.
Основная предпосылка теории VSEPR состоит в том, что пары валентных электронов вокруг атома отталкиваются друг от друга, так что расположение электронных пар принимает такое расположение, которое сводит к минимуму силу отталкивания. Минимизация сил отталкивания между этими электронными парами определяет геометрию молекулы. Число электронных пар вокруг атома известно как стерическое число.
Теорию VSEPR обычно сравнивают с теорией валентной связи, которая рассматривает молекулярную форму через орбитали, которые могут связываться энергетически. Теория валентной связи занимается образованием сигма- и пи-связей. Теория молекулярных орбиталей - еще одна модель, используемая для объяснения того, как атомы и электроны организованы в многоатомные молекулы и ионы.
Теория VSEPR используется для предсказания формы ковалентных связей.
(Также читайте: Роль химии в жизни)
Главный постулат
Теория VSEPR утверждает, что форма молекулы зависит от пары электронов и валентной оболочки. Согласно этой теории:
1. Форма молекулы зависит от количества пар валентных электронов в оболочке вокруг центрального атома.
2. Пары электронов в валентных оболочках отталкиваются друг от друга, потому что их электронное облако заряжено отрицательно.
3. Эти пары электронов стремятся занимать такие позиции в пространстве, которые сводят к минимуму отталкивание и тем самым максимизируют расстояние между ними.
4. Валентная оболочка принимается как сфера, электронная пара которой располагается на поверхности сферы на максимальном расстоянии друг от друга.
5. Двойная связь рассматривается как одинарная пара электронов, а две или три пары электронов из двойной связи рассматриваются как супер-одинарные пары.
6. Модель VSEPR применима к любой структуре, где две или более резонансных структуры могут представлять молекулу.
Преимущества теории VSEPR
С помощью теории VSEPR легче разделить молекулы на две категории: (i) молекулы, в которых центральный атом не имеет неподеленной пары, и (ii) молекулы, в которых центральный атом имеет одну или несколько неподеленных пар.