Вы когда-нибудь видели большой воздушный шар, на котором могут летать люди? Если в Мире, конечно, такое представление будет встречаться очень редко. Однако за рубежом этого не происходит. Один из них находится в Турции, которая сделала воздушные шары одним из главных аттракционов для привлечения туристов. Этот вид встречается очень часто, потому что это один из туров по стране. Итак, для того, чтобы воздушный шар летал высоко, необходим газообразный гелий, который является разновидностью благородного газа.
Конечно, помимо наполнения воздушного шара, несколько типов благородных газов также имеют ряд преимуществ в повседневной жизни благодаря своим физическим и химическим свойствам. Давайте посмотрим на объяснение, чтобы лучше понять это!
На сегодняшний день существует около 118 химических элементов, и более ста видов элементов определили свои свойства и преимущества либо в форме свободных элементов, либо в их сложной форме. Таблица Менделеева сгруппирована в несколько групп, и одна из них обладает свойствами, которые очень трудно реагировать с другими элементами, а именно с благородными газами, входящими в группу VIIA (18).
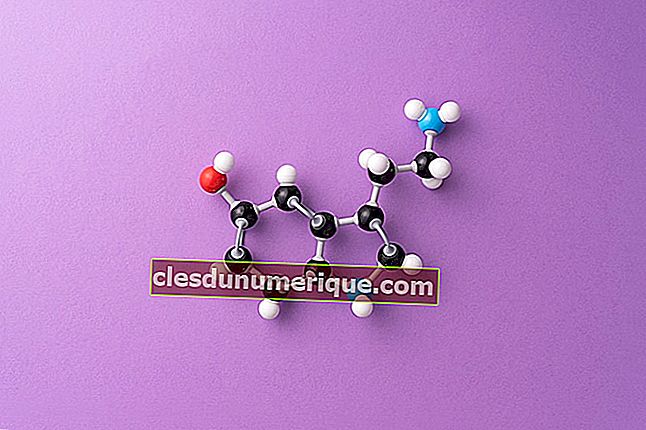
Редкие газы являются стабильными элементами из-за их полностью заполненной электронной конфигурации. Следовательно, этот газ трудно реагировать с другими элементами, и трудно принимать или удалять электроны. Элементы, обнаруженные в благородных газах, включают гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Все эти газы содержат очень мало на земле в сухом воздухе.
Свойства благородных газов
Кроме того, благородные газы обладают известными свойствами, которые можно разделить на два типа, а именно физические свойства и химические свойства.
- Физические свойства
В силу своих физических свойств при комнатной температуре это газообразный элемент, температура кипения которого всего на несколько градусов выше его точки плавления. Кроме того, точки плавления и кипения этого газа очень низкие, так что точки кипения и плавления этого газа тем выше, чем больше атомный номер. Силы притяжения между атомами (связи Ван-дер-Ваальса) очень слабые.
- Химические свойства
Реакционная способность благородных газов увеличится от He до Rn, это связано с увеличением атомного радиуса, что приводит к уменьшению притяжения ядра к электронам внешней оболочки, что облегчает его притяжение к другим атомам. Но инертные газы являются нереактивными элементами, потому что они имеют стабильную электронную конфигурацию. Это подтверждается тем фактом, что в природе этот газ всегда присутствует в виде одного атома или одноатомного.
(Также прочтите: Понимание физических и химических изменений и примеров)
Что касается благородных газов с периодом 3 и выше, таких как Ar, Kr, Xe и Rn, они могут реагировать с очень электроотрицательными элементами, такими как фтор и кислород.
Функции благородных газов
Как известно, элементы из благородных газов состоят из 6 видов: гелий, неон, аргон, криптон, ксенон и радон. Каждый из этих элементов имеет свои преимущества для жизни человека. Что-нибудь?
- Гелий
Помимо использования для наполнения воздушных шаров, инертный гелий также может использоваться для замены азота для создания искусственного воздуха для использования при погружениях на морском дне. Гелий, который является жидким, также может использоваться в качестве хладагента, поскольку он имеет очень низкую точку парообразования.
- Неон
Неон обычно используется для заливки люминесцентных ламп. Кроме того, неон также может использоваться для различных вещей, таких как индикаторы высокого напряжения, хладагенты, громоотводы и заполнение телевизионных трубок.
- Аргон
Этот элемент с благородным газом можно использовать при сварке титана и нержавеющей стали. Аргон также используется при сварке и в качестве наполнителя для ламп накаливания.
- Криптон
Криптон вместе с аргоном используется как наполнитель для люминесцентных ламп низкого давления. Криптон также используется во вспышке для высокоскоростной фотографии.
- Ксенон
Ксенон может использоваться в производстве ламп для бактерицидов (убийц бактерий) и в производстве электронных ламп.
- Радон
Этот тип химического элемента полезен для здоровья, поскольку его можно использовать в терапии рака, поскольку он радиоактивен. Радон также может действовать как система предупреждения о землетрясениях.